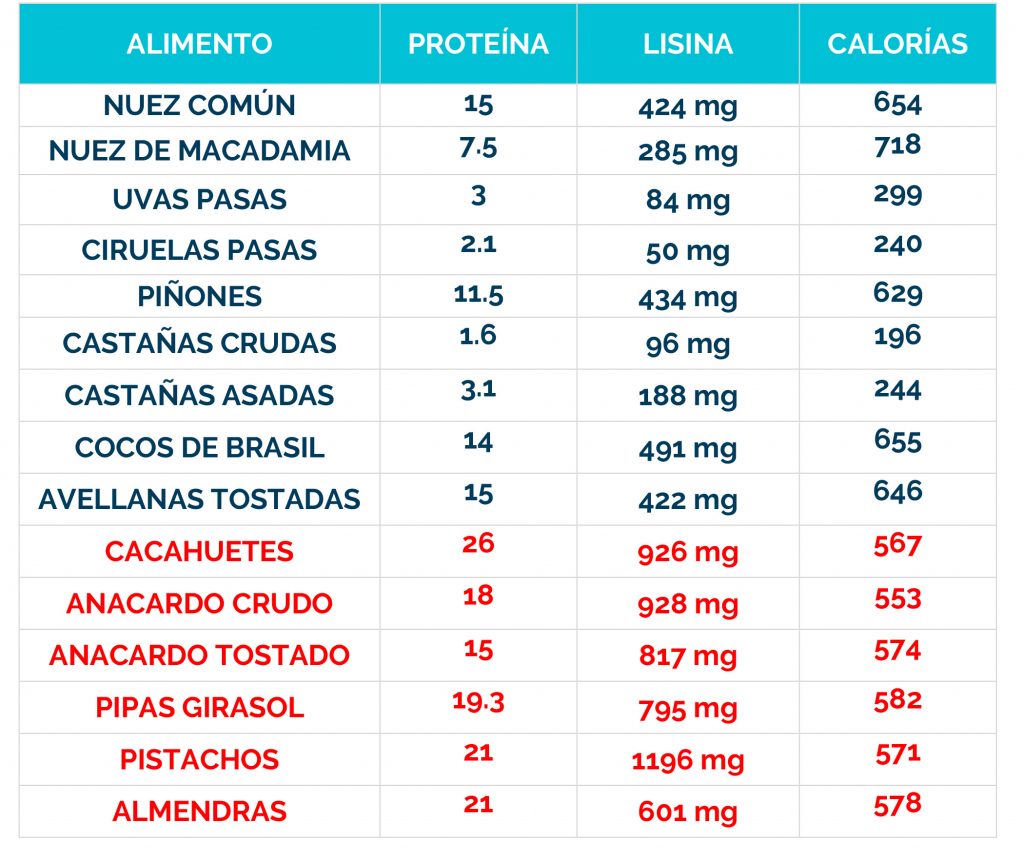
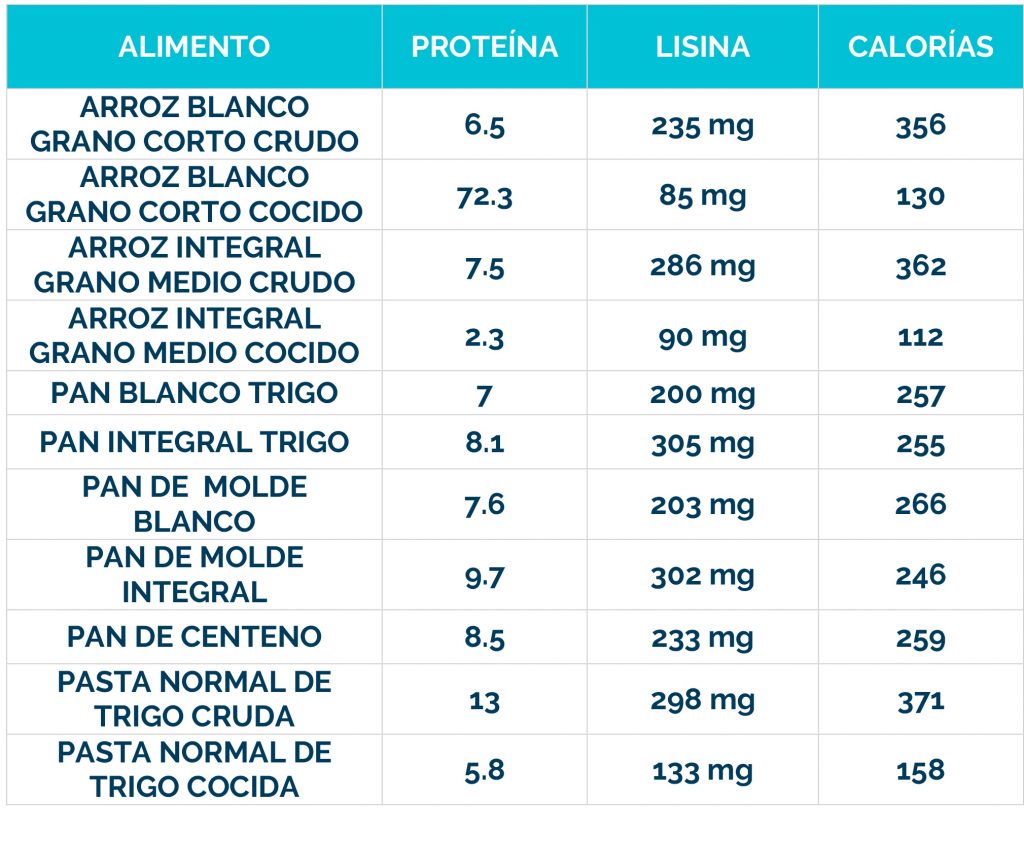
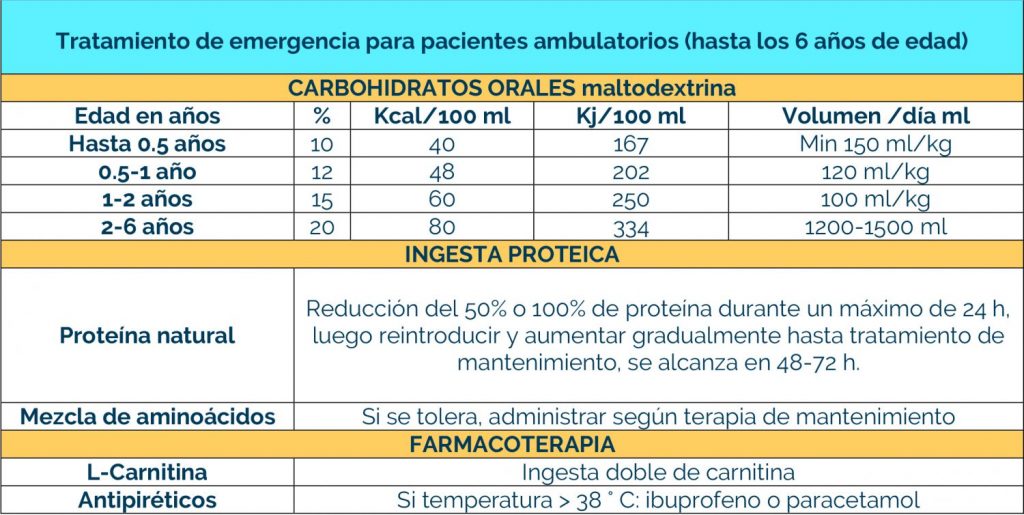
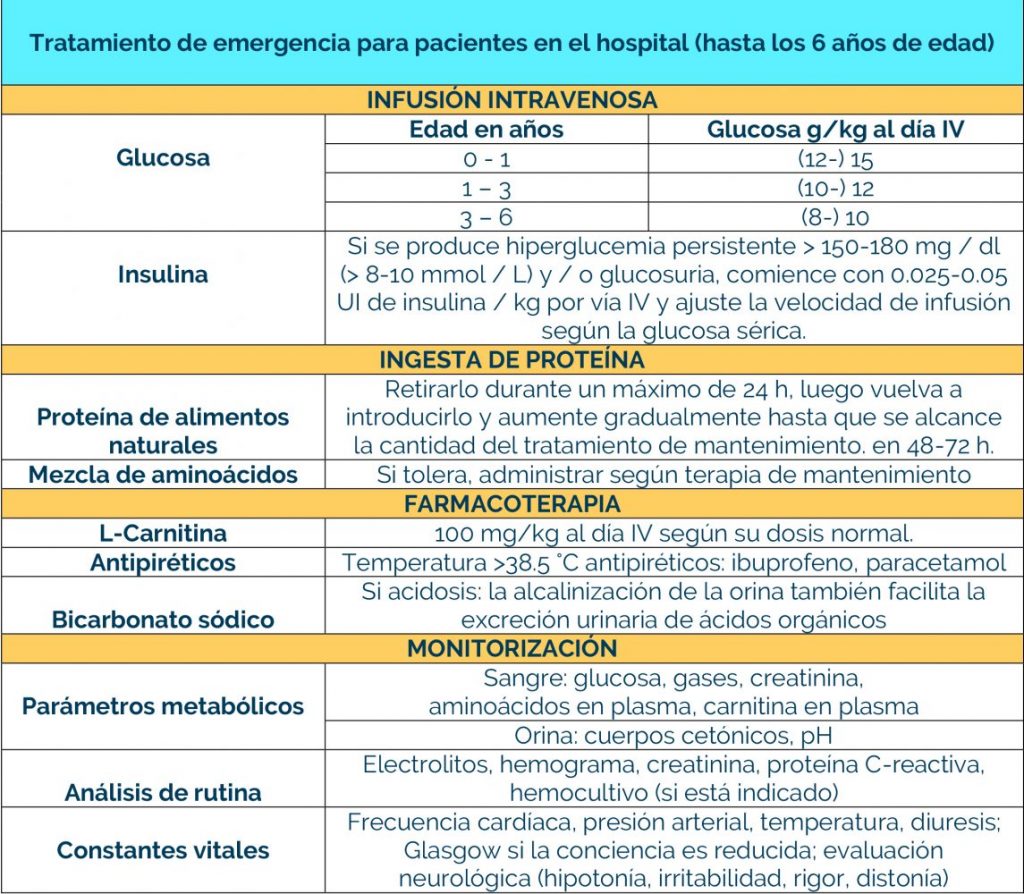
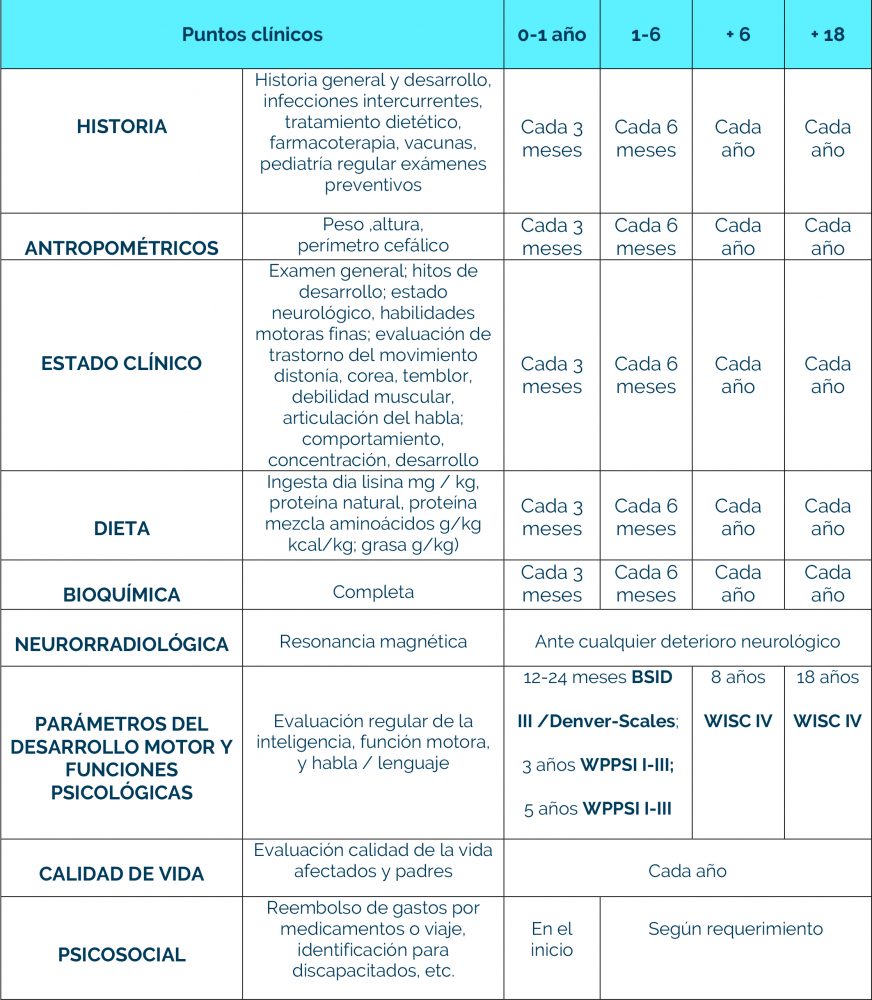
Complicaciones neurológicas
Las principales complicaciones neurológicas comprenden el inicio agudo o insidioso de MD distónico y SDH/higroma (principalmente dentro de los tres primeros años de vida). La prevalencia de la epilepsia no se incrementó en los primeros individuos tratados de la dos cohortes más grandes de NBS en todo el mundo, pero se ha informado en pacientes sintomáticos no identificados por NBS (*5,34,89).
Manejo de los trastornos del movimiento
La lesión del estriado da como resultado una DM compleja que se manifiesta principalmente como distonía (y/o corea) con superposición de hipotonía muscular. Con la edad, la DM distónica puede evolucionar de móvil a fija y puede estar asociada con parkinsonismo acinético-rígido o espasticidad (*24,32,37,55,153,163). La distonía reduce la calidad de vida, causa dolor y posiblemente crisis potencialmente mortales (status dystonicus). La distonía grave se asocia con un aumento de la mortalidad

Escalas de calificación de distonía
La evaluación de la MD distónica debe comprender la localización clínica y la gravedad. La escala de clasificación de la distonía de Barry-Albright (*164,165) se ha utilizado en algunos estudios (*32,166), pero puede tener un uso limitado en bebés y niños pequeños ya que probablemente subestima la gravedad de la distrofia muscular en este grupo de edad debido a la hipotonía grave del tronco (*32). La FahnMarsden Dystonia Rating Scale (FMDRS) se ha utilizado en la DM hipercinética, incluida la parálisis cerebral, y es recomendada para la evaluación de la distonía generalizada, pero no evalúa áreas individuales del cuerpo y no ha sido probada para GA1 (*167,168).
Terapia de drogas
La MD distónica generalmente es difícil de tratar y la evidencia sobre la efectividad de medicamentos específicos es escasa. (*169) haciendo imposible una recomendación específica para el tratamiento de la DM. Se enumeran las sustancias más utilizadas.
Baclofeno: el baclofeno es un derivado del ácido gamma aminobutírico (GABA) y un relajante muscular centralmente activo, que aumenta la inhibición presináptica espinal y, por lo tanto, disminuye el tono muscular. Junto con las benzodiacepinas el baclofeno (como monoterapia o terapia combinada) es el fármaco más utilizado y aparentemente eficaz para el tratamiento a largo plazo de MD en GA1 (*37,153), y la dosificación debe seguir las recomendaciones generales. En niños más pequeños con hipotonía axial prominente, el uso de baclofeno puede verse limitado debido al empeoramiento de la hipotonía muscular. En varios estudios, también la administración intratecal de baclofeno fue exitosa si el tratamiento oral no fue efectivo (*35,170-172).
Benzodiazepinas: el diazepam y el clonazepam a menudo se usan en combinación con baclofeno y mostraron resultados positivos en más del 90% de los individuos sintomáticos (*35,37,153). Las dosis deben administrarse de acuerdo con las recomendaciones generales. Para prevenir la taquifilaxia, puede ser necesario un tratamiento intermitente.
Zopiclona y Zolpidem: La zopiclona es una ciclopirrolona con propiedades sedantes, hipnóticas, ansiolíticas y relajantes musculares. A diferencia de otras benzodiazepinas, su efecto farmacodinámico está mediado de forma no selectiva por el complejo receptor GABA-A y GABA-Ω-(BZ1 y BZ2) y la modulación del canal de cloro, con bajo riesgo de desarrollar tolerancia y adicción. Los individuos tratados no muestran aumento de la somnolencia diurna pero, en por el contrario, están más relajados y despiertos durante el día ya que se ven menos afectados por su DM durante la noche.
Es importante la adaptación cuidadosa de la dosis y la reducción gradual, preferiblemente en un entorno hospitalario.
Los efectos positivos de la zopiclona, utilizada principalmente en la distonía no metabólica, se demostraron al reducir los elementos hipercinéticos de MD y tono muscular (*173).
Zolpidem, una imidazopiridina, es un fármaco similar a las benzodiazepinas con cualidades hipnóticas y un agonista con alta afinidad por la subunidad del receptor Ω-(BZ1) del receptor GABA-A. Mostró efectos positivos en un estudio con 34 adultos distónicos, particularmente en la distonía generalizada y la distonía que afecta principalmente a las manos. Los efectos demostraron ser comparables con el trihexifenidilo 174.
Fármacos anticolinérgicos: Si el tratamiento con baclofeno y/o benzodiazepinas no es eficaz o aparecen efectos adversos, los medicamentos anticolinérgicos pueden considerarse como medicamentos de segunda línea. La evidencia sobre el trihexifenidilo es heterogénea. Ha demostrado ser eficaz en casos individuales (*169), también en niños con distonía secundaria (*175,176). Una revisión publicada recientemente evaluó el trihexifenidilo como posiblemente ineficaz en pacientes con síndrome distónico en parálisis cerebral (*170). Algunos efectos adversos (p. ej., visión borrosa y boca seca) suelen ser temporales, mientras que la pérdida de memoria y la confusión en su mayoría persisten y requieren una reducción de la dosis. La tonometría ocular debe ser regularmente realizado en adultos.
Toxina botulínica: se utilizó con éxito la toxina botulínica tipo A, generalmente administrada cada tres a seis meses.para prevenir la dislocación de la cadera y reducir la distonía de las extremidades (*169.) Algunas personas pueden desarrollar anticuerpos contra la toxina que requiere la interrupción del tratamiento (*177).
Gabapentina: la gabapentina modula los canales de calcio dependientes de voltaje reduciendo la excitación de la neurotransmisión en el SNC. Disminuye el tono muscular, tiene cualidades analgésicas y antiepilépticas adicionales y tuvo efectos positivos sobre la distonía, el dolor, la calidad de vida y el sueño en un estudio retrospectivo con 69 niños sin GA1 (*178).
Fármacos sin beneficios ni efectos adversos: en el pasado, también se han utilizado medicamentos anticonvulsivos para tratar MD en GA1 (*35,37,153): Vigabatrina y valproato mostraron beneficio clínico en 10-25%. La vigabatrina puede inducir defectos del campo visual periférico e hiperintensidades T2 (en su mayoría reversibles) en el pálido, el tálamo y el tronco encefálico como efectos secundarios putativos. El valproato puede influir negativamente en la relación mitocondrial acil-CoA/CoA. Por lo tanto, estos medicamentos no deben usarse para el tratamiento en GA1. En la experiencia clínica del GDG, Carbamazepina, L-DOPA y la amantadina fueron ineficaces.
Neurocirugía
Se ha informado cirugía estereotáctica (palidotomía) en tres individuos gravemente distónicos con GA1. En dos pacientes, el resultado clínico fue pobre (*55), mientras que en otro se informó la mejoría a corto plazo de la distonía (*179). No se dispone de datos sobre el resultado a largo plazo después de la palidotomía. La estimulación cerebral profunda bilateral del globo pálido interno redujo la distonía y mejoró ligeramente la función motora en un paciente (*180) mientras que también se observó mejoría en un paciente con hemidistonía atípica por necrosis estriatal unilateral tras crisis encefalopática aguda (*36). Sin embargo, no se detectó ningún efecto en otro paciente con MD clásica grave de inicio agudo (comunicación personal Dr. Cif, Montpellier). Aunque los efectos positivos en la escala del dolor fueron reportados (*181), hubo un resultado motor dispar con una ligera mejoría pero también se observó una disminución después de la estimulación cerebral profunda en pacientes con distonía heredodegenerativa, incluidos dos pacientes con GA1 (*182). Sin embargo una revisión reciente, sin incluir GA1, mostró un efecto positivo principalmente en 52 niños con distonía primaria (por ejemplo, DYT1-asociado) en contraste con el resultado heterogéneo en 24 individuos con distonía secundaria (*183).
Tratamiento ortopédico
En un estudio retrospectivo el 30% de 114 pacientes sintomáticos fueron intervenidos quirúrgicamente por complicaciones ortopédicas (por ejemplo, escoliosis, dislocación de cadera) (*184).
Epilepsia
La prevalencia de la epilepsia no aumentó en los individuos tratados tempranamente de las dos cohortes más grandes de NBS en todo el mundo (*5,34), pero se informó en pacientes con diagnóstico tardío (*89). Las convulsiones se informaron particularmente durante o poco tiempo después de una crisis encefalopática aguda (*24,35,37,55,152) pero la MD distónica también puede confundirse con convulsiones (*185). No existen estudios sobre la eficacia de los agentes antiepilépticos. Por lo tanto, la elección del tratamiento debe seguir a la semiología de las convulsiones y los patrones EEG. Deben evitarse el valproato y la vigabatrina debido a su riesgo de desarrollar disfunción mitocondrial.
Hemorragia subdural y quistes aracnoideos
Neurocirugía (consulte también la recomendación n.° 12): solo están disponibles unos pocos informes anteriores de personas con GA1 que se someten a procedimientos neuroquirúrgicos para tratar quistes aracnoideos y/o SDH (*109,112,114,115). Durante el postoperatorio el resultado neurológico fue mayormente malo y los síntomas a menudo empeoraron. Además, las intervenciones neuroquirúrgicas en individuos no diagnosticados y no tratados aumenta el riesgo de crisis encefalopática aguda. Durante el perioperatorio el manejo metabólico debe basarse en las recomendaciones no. 10 y 11 para tratamiento de emergencia y ser supervisado por un centro especializado con experiencia en el tratamiento de enfermedades metabólicas hereditarias.